病例摘要
患儿龙XX,男,9岁,诊断:急性T淋巴细胞白血病(T-ALL)复发伴多发髓外白血病(睾丸、中枢神经系统),亲缘半相合造血干细胞移植后1年3月。
2016年9月患儿出现双侧多发颈部淋巴结肿大,直径约1-2cm,无压痛,无发热,在当地医院予抗生素治疗后淋巴结肿大逐渐消失。2016年10月初患儿再次出现颈部淋巴结肿大且逐渐加重,最大直径约5-6cm,伴有发热,最高体温39℃,在当地医院予抗感染治疗,淋巴结缩小约2/3,体温降至正常。在当地医院查血常规白细胞明显增高,遂于2016年10月19日就诊于北京大学人民医院。血常规:白细胞409.68×109/L,淋巴细胞占84.9%,血红蛋白116g/L,血小板50×109/L;骨髓:原幼淋71%;免疫分型:异常淋系表型,P3占68.38%,表达CD7,CD38,CD8,cCD3,TdT,CD5,CD2,CD45,部分细胞表达mCD3,不表达CD10,CD19,CD34,CD117,CD33,CD57,CD1a,CD15,CD4,CD56,CD16,CD123;融合基因:阴性;IgH阴性,TCRδ阴性;染色体:46,XY,t(11:14)(p13:q11)[3]/46,XY[17],B超:肝大,诊断为T-ALL。予VDLP方案化疗诱导,第15天骨髓:幼淋4%;流式:cCD3+T细胞占17.54%,表型为cCD3+mCD3+CD5+TdT-CD99-,为成熟T淋巴细胞。后予CAM、大剂量MTX、VDL、大剂量Ara-c等方案巩固化疗9个疗程,期间腰穿24次均未见异常,骨髓均为完全缓解状态。
2017年11月13日转至北京博仁医院,入院评估病情,骨髓:缓解状态;行腰穿及鞘注,脑脊液未见恶性幼稚细胞。11月18日始予HDAra-c+IDA化疗,12月13日复查B超:左侧睾丸中极可见一个0.58×0.69×0.47cm的包块,计划先行睾丸局部放疗后进行亲缘半相合造血干细胞移植。12月21日始睾丸放疗,共7天,总量1400cGy。2018年1月1日患儿发生水痘感染,给予抗病毒治疗,期间白细胞进行性升高且快速倍增,高达130x109/L,外周血可见原始细胞,提示白血病复发。在水痘感染期间予VP-16+Ara-C减白血病负荷化疗。1月12日予Flu+Ara-C+Acla+G-CSF化疗。骨髓基因变异:NRAS、FBXW7、NOTCH1、PTEN、PTPN11(图1)。
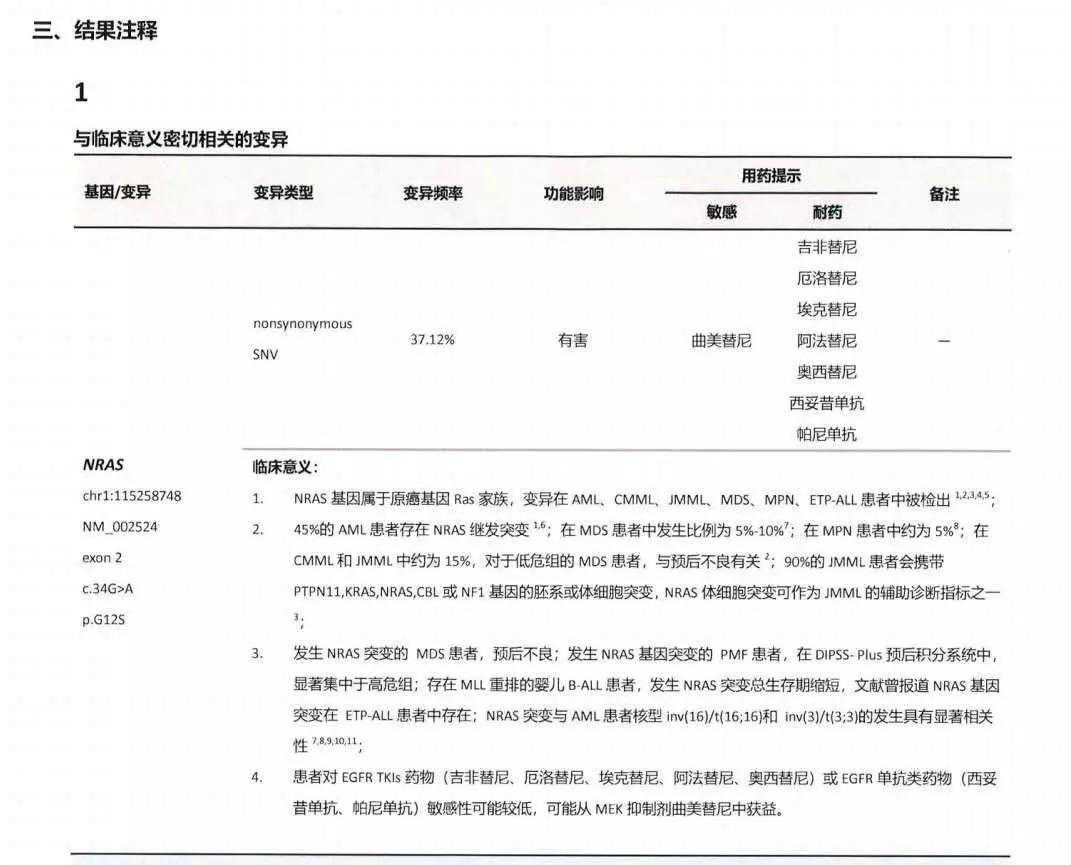
图1:2018年1月NGS深度测序查基因突变(移植前血液学复发状态)
1月17日予VLD化疗,同时予舒尼替尼及西达苯胺。1月29日骨髓:增生减低,原幼细胞5%,流式:4%T-ALL细胞。遂完善造血干细胞移植前相关检查,准备行造血干细胞移植,但2月11日患儿突发右侧面瘫,脑脊液常规:白细胞3838×106/L,单个核细胞99.7%;脑脊液生化:蛋白:0.61g/L,糖:2.51mmol/L,考虑为中枢神经系统白血病,予腰穿及鞘内注射。2月14日始予HDMTX,DEX,培门冬酶化疗。2月22日行骨穿,骨髓:原幼淋占73.5%,流式:54.36%细胞为表型异常的幼稚T细胞。
2月26日开始挽救性半相合造血干细胞移植(父供子,HLA配型4/6相合,血型B+供B+),预处理方案:TBI+FLU+VP16+Me-CCNU+ATG。3月12日和13日回输供者造血干细胞,×108/kg,CD34+细胞14.34×106/kg。移植后予短程甲氨喋呤、环孢素、骁悉预防GVHD,+15天白细胞、血小板植活。移植后第一个月评估,白血病为缓解状态,残留白血病为0,骨髓及外周血CD3+细胞嵌合率均为完全供者型。移植后患儿面瘫及睾丸肿大逐渐缓解
患儿系难治性T-ALL,移植前白血病负荷高且细胞快速倍增,伴有髓外白血病,为挽救性移植,鉴于上述诸多高危因素,预计该病例移植后几乎会早期复发。为了预防复发,我们根据该患儿存在NRAS基因变异而选择靶向药物——曲美替尼做移植后的维持治疗。2018年6月底(移植后+3月余)患儿开始口服曲美替尼0.5mg/天至今,2018年7月中旬复查骨髓未发现NRAS变异(图2)。
图2:移植后+4月NGS深度测序未检测到NRAS变异
移植后患儿出现轻度慢性GVHD,主要表现为少量散在皮疹,肝脏转氨酶略高。环孢素浓度维持在低水平,且于移植后+8月停用。患儿至今为造血干细胞移植后1年3月,白血病为持续完全缓解状态,且残留白血病持续为0,无髓外白血病。
讨论
急性淋巴细胞白血病是儿童最常见的肿瘤,其中T-ALL占10-15%。目前儿童B-ALL的5年无事件生存(EFS)及总体生存(OS)分别超过80%和90%,但儿童T-ALL的5年EFS及OS比B-ALL差,尤其复发T-ALL的5年生存率仅约20%。这例患儿治疗过程中首先发生髓外复发,表现为睾丸白血病,随后出现血液学复发,最后又发生中枢神经系统白血病,且白血病细胞倍增迅速,化疗效果差,属于难治性T-ALL,预后极差。
该病例血液学复发后采用二代测序检测到NRAS、FBXW7、NOTCH1、PTEN、PTPN11变异,NRAS变异频率为37.12%。NRAS基因属于原癌基因RAS家族,负责编码N-Ras蛋白,N-Ras蛋白通过参与RAS-RAF-MEK-ERK通路,调控基因转录和细胞周期,与细胞增殖密切相关。当NRAS基因发生变异时其编码的N-Ras蛋白将处于持续激活状态,导致细胞增殖失控,进而形成肿瘤。NRAS变异多见于黑色素瘤、急性髓系白血病、结直肠癌,亦可见于T-ALL。
患儿为挽救性移植,且白血病细胞负荷高、倍增快,因此极易发生移植后早期复发,为预防复发,我们采取了以下措施:1、尽早减停抗GVHD药物:将免疫抑制剂环孢素浓度控制在低水平,且尽早减停(+8月停用);2、靶向药物维持治疗:因患儿存在NRAS变异,移植后采用MEK抑制剂曲美替尼做维持治疗。患儿+3月开始口服曲美替尼,+4月复查骨髓未检测到NARS突变,证明异基因移植清除了具有NRAS变异的白血病细胞,继续口服曲美替尼维持治疗至今。现患儿移植后1年3月,白血病为持续缓解状态,无明显移植相关的不良事件。
此病例提示我们对于高危复发的白血病,异基因造血干细胞移植并不是终极治疗,如果患者存在基因变异且有靶向药物可选的话,可以在建立了供者造血与免疫系统平台后采用靶向药物做维持治疗,以持续清除可能残存的白血病细胞,从而降低复发率,提高治愈率。二代测序技术尤其是深度测序可以检测出更多的基因变异从而有助于筛选出相应的靶向药物,且部分基因变异可以作为监测残留白血病的标记,以便判断治疗反应。

赵永强
血液二科(移植技术)
主治医师医学硕士
擅长:具有多年血液科及造血干细胞移植工作经验。熟练掌握常见血液病的诊断、鉴别诊断及治疗。包括再生障碍性贫血、MDS、急性髓性白血病、急性淋巴细胞白血病等。对于处理造血干细胞移植相关的并发症,如感染、GVHD、复发、出血性膀胱炎等积累了较为丰富的经验。
标签:





